Тромбоцитарные концентраты (ТК) используются для улучшения процесса заживления в ходе выполнения медицинских и стоматологических манипуляций на протяжении уже более 50 лет. Факторы роста, входящие в состав ТК, впервые были идентифицированы Ross и коллегами. В стоматологии ТК применяются в основном для заживления костной ткани и мягких тканей слизистой. Первое поколение ТК – плазма, обогащённая тромбоцитами (PRP), второе поколение – обогащенный тромбоцитами фибрин (PRF), стимулируют восстановление и регенерацию тканей зубочелюстного аппарата. Данные материалы содержат повышенную концентрацию факторов роста и цитокинов, которые присутствуют на физиологическом уровне в тромбоцитах in vivo. ТК также могут содержать так называемые биологические каркасы (скэфолды), которые, в свою очередь, могут индуцировать высвобождение факторов роста и цитокинов из окружающих тканей во время процесса заживления. Среди факторов роста следует выделить следующие: фактор роста тромбоцитов (PDGF), трансформирующий фактор роста-β (TGF-β), костный морфогенетический белок-2 (BMP-2) и фактор роста эндотелия сосудов (VEGF).

В стоматологии наиболее часто используются два типа тромбоцитарных концентратов. Плазма, обогащенная тромбоцитами (PRP, или лейкоцитарная PRP [L-PRP]), — это концентрат антикоагулированной крови, состоящий из лейкоцитов и высокой концентрации тромбоцитов в результате двойного центрифугирования. Для приготовления PRP перед клиническим применением также требуется использовать активатор. Фибрин, обогащенный тромбоцитами (PRF или L-PRF), характеризуется высокой концентрацией тромбоцитов и лейкоцитов в плотной фибриновой матрице. PRF не требует применения активатора перед использованием и готовится из цельной крови после одиночного этапа центрифугирования.
Кроме того, в литературе описаны разные другие подходы приготовления ТК (например, нагревание или формование с использованием шаблонов) для улучшения их манипуляционных характеристик и оптимизация времени их применения. Показаниями для применения ТК являются потребность в усиление процесса регенерации мягких и твердых тканей, особенно в качестве адювантного материала с разными формами трансплантатов. На сегодняшний день проведено много клинических исследований, посвященных изучению эффективности применения ТК для улучшения результатов лечения внутрикостных пародонтальных дефектов, фуркационных дефектов, в процессе проведения направленной костной регенерации и закрытия рецессий десен.
Эволюция тромбоцитарных концентратов: ТК первого и второго поколений
Тромбоциты являются важным компонентом системы гемостаза и стабилизации области раны. Во время заживления после травмы тромбоциты являются основным источником факторов роста. Во время приготовления ТК тромбоциты из аутогенной крови высвобождают свои факторы роста, и эти факторы роста концентрируются в ходе центрифугирования. Методы приготовления ТК эволюционировали с течением времени и значительно упростились, при этом обеспечивая высокую эффективность применения вышеупомянутых материалов.
ТК первого поколения: обогащенная тромбоцитами плазма
PRP — это аутологичный биологический материал, который формируется из фракции плазмы крови с концентрацией тромбоцитов, превышающей таковую в цельной крови в пять-восемь раз. После того, как PRP была первоначально идентифицирована как потенциальный источник факторов роста, она впоследствии продолжает активно использоваться в различных областях медицины, включая дерматологию и ортопедию, а также в ходе хирургических вмешательства в челюстно-лицевой области. PRP содержит высокую концентрацию тромбоцитов, но минимальное количество фибриногена. Альфа-гранулы тромбоцитов, высвобождаемые во время приготовления PRP, содержат факторы роста, которые остаются активными на протяжении 3-5 дней. Именно они индуцируют фазу пролиферации на протяжении приблизительно 7 дней после применения PRP, что соответственно способствует заживлению раны в области вмешательства. Также факторы роста могут усиливать миграцию и дифференцировку остеопрогениторных клеток и активировать ангиогенез во время начального заживления ран. PRP является полностью биосовместимым материалом и, поскольку он аутологичен по своему происхождению, то риск передачи какого-либо заболевания сведен к нулю. Однако процесс приготовления PRP должен придерживаться строгого протокола и предусматривает применение добавок, которые обеспечивают быструю полимеризацию фибрина. Именно быстрая полимеризация ответственная за формирование слабой фибриновой сетки и жидкую консистенцию ТК. Стабильность PRP in vitro, как и кинетические характеристики релизинга и активации факторов роста, характеризуются специфическими временными ограничениями.
ТК второго поколения: обогащенный тромбоцитами фибрин
PRF — это ТК второго поколения, впервые разработанный в 2001 году для использования специально в челюстно-лицевой области. Применение PRF во время реконструктивных манипуляций на мягких и твердых тканях полости рта продемонстрировало ускоренное заживление таковых. PRF также именуется фибрином, обогащенным лейкоцитами и тромбоцитами (L-PRF), поскольку он содержит большое количество лейкоцитов и имеет гелеобразную консистенцию, которая позволяет формовать его в гибкую мембрану и/или смешивать с материалом используемого трансплантата. Предварительно сообщалось как об эффективности изолированного применения PRF в стоматологической практике, так и об успешности его комбинирования с другими материалами.
PRF формируется после прогрессивной полимеризации ТК, которая развивается во время и непосредственно после центрифугирования. В ходе приготовление PRF не требуется использование никаких дополнительных материалов, что снижает его стоимость и обеспечивает простоту в применении. Кроме того, PRF содержит фибриновый матрикс с большим количеством лейкоцитов и цитокинов по сравнению с ТК первого поколения, из-за этого структурная целостность PRF обычно приближается к гелеобразной или мембраноподобной консистенции. Фибриновая матрица PRF обеспечивает более постепенное и устойчивое высвобождению факторов роста и гликопротеинов матрикса, тем самым плотнее коррелируя с естественным процессом заживления. Структурная целостность PRF позволяет адаптировать его в качестве мембраны или матрицы. По данным исследований известно, что комбинация PRF с костными трансплантатами улучшает возможности для его адаптации в ране и способствует сохранению стабильности первичного объема. Из-за естественного процесса полимеризации количество PRF, сформированное из забранного объема крови, может быть разным. Приготовление PRF следует проводить незадолго до его клинического использования, поскольку обезвоживание ТК может привести к усадке или потере структурной целостности во время хранения. Присутствие лейкоцитов в структуре сгустка может усиливать биологические свойства PRF за счет улучшения его иммунной и противомикробной функций. Наличие лейкоцитов частично может способствовать регулированию релизинга факторов роста в области раны.
По сути, после забора крови и центрифугирования кровяной сгусток разделяется на три фазы: бесклеточная плазма, буферный слой (плазма обогащенная факторами роста – PRGF) и эритроциты. После вторичного центрифугирования и добавления антикоагулянта врач может получить PRP, если же полимеризация сгустка происходить естественно без дополнительной полимеризации – то врач получает PRF.
Клиническое значение ТК в стоматологии
В настоящее время ТК используется во многих отраслях стоматологии, но наиболее часто в пародонтальной и челюстно-лицевой хирургии. ТК способствует заживлению раны как после твердотканной, так и после мягкотканой аугментации, а применение данных гемогенных материалов еще и повышает пациент-ассоциированные параметры качества проведенного лечения. Так, например, использование ТК позволяет уменьшить выраженность болевых ощущений в послеоперационный период. Кроме того, современные подходы к обработке PRF позволяют увеличить период активности сгустков от 2-3 недель до 4-6 месяцев, что крайне важно в клинических ситуациях, которые предусматривают длительный период заживления после вмешательства.
Влияние ТК на клетки в процессе регенерации тканей полости рта
Факторы роста, выделяемые ТК, играют важную роль в заживлении ран и включают PDGF, TGF-β, VEGF, фактор роста эпителия (EGF) и инсулиноподобный фактор роста (IGF-1), а также основной фактор роста фибробластов (bFGF) и определенные белки крови, которые, как известно, действуют как молекулы клеточной адгезии, способствуя остеокондукции. Исследования in vitro, оценивающие влияние ТК на отдельные типы клеток полости рта, продемонстрировали различные результаты в отношении пролиферации и дифференцировки фибробластов и остеобластов. Так PRF ассоциировано с ингибированием остеопротегерина и повышением экспрессии щелочной фосфатазы, что потенциально может указывать на то, что PRF способно индуцировать дифференцировку стволовых клеток пародонтальной связки в остеобласты. Еще одним преимуществом ТК является их противомикробные свойства; PRP и PRF в условиях in vitro способствовали ингибированию роста таких бактерий как Porphyromonas gingivalis, так и Aggregatibacter actinomycetemcomitans. Исследования также показывают, что ТК могут подавлять долгосрочную экспрессию провоспалительных цитокинов и, следовательно, ограничивать развитие местных и системных признаков хронического воспаления.
Дополнительное использование ТК при регенерации твердых тканей
Использование ТК при аугментации костной ткани уменьшает объем костного трансплантата, необходимого для проведения вмешательства, ускоряет процесс заживления и стимулирует формирование новой костной ткани при направленной костной регенерации (НКР) и пародонтальной направленной регенерации тканей (НРТ) по сравнению с результатами, которые были зарегистрированы лишь при изолированном применении соответствующих аугментатов. Кроме того, дополнительное использование ТК вместе с костным заменителем в ходе выполнения процедуры синус-лифта способствует более выраженному формированию новой костной ткани в случаях комбинации с деминерализованным лиофилизированным костным аллотрансплантатом (FDBA), но не при использовании с бесклеточным костным матриксом, полученным от крупного рогатого скота (ABBM). PRF-мембраны могут быть использованы для закрытия перфораций Шнайдеровой мембраны и латерального окна доступа (фото 1-6).
Фото 1. Выполнение процедуры синус-лифта: подготовка латерального окна и поднятие Шнайдеровой мембраны.
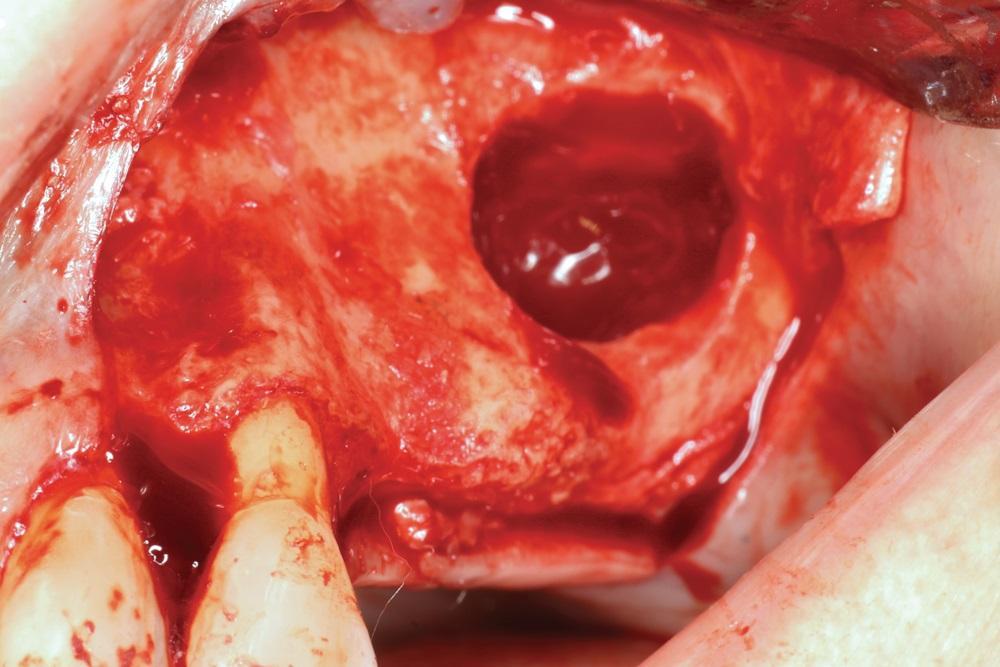
Фото 2. L-PRF мембраны из аутологической крови.
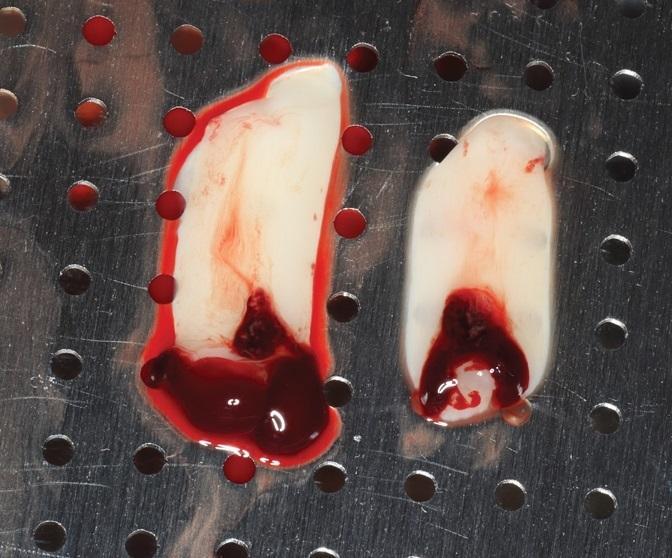
Фото 3. Комбинирование L-PRF с костным трансплантатом FDBA для использования в процессе синус-лифта.
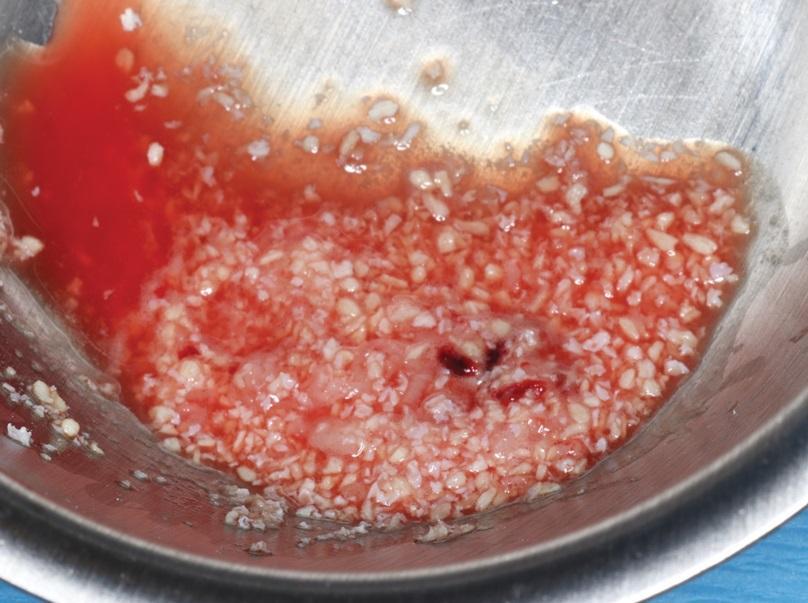
Фото 4. Установка костного аугментата.
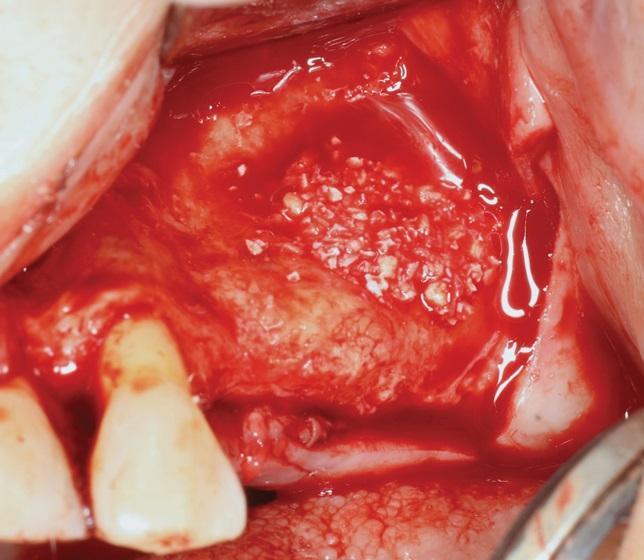
Фото 5. Одновременная направленная регенерация костной ткани с перекрытием участка вмешательства коллагеновой мембраной.
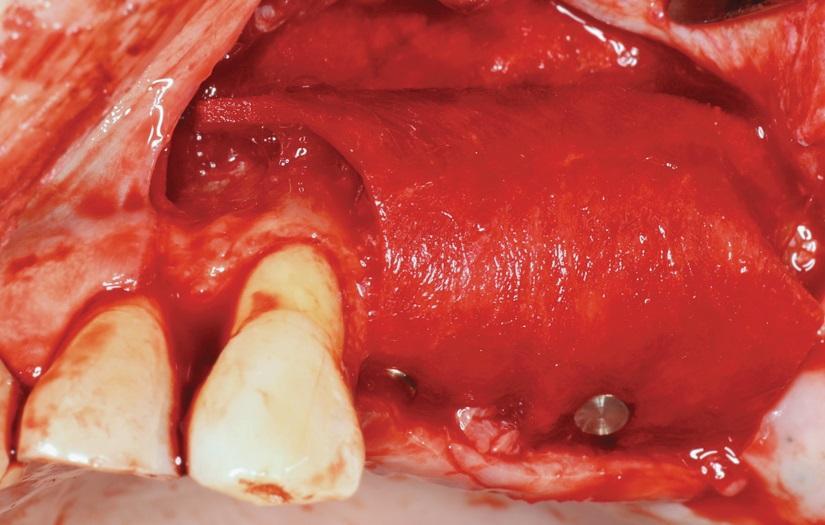
Фото 6. L-PRF мембрану использовали для дополнительного перекрытия участка вмешательства.
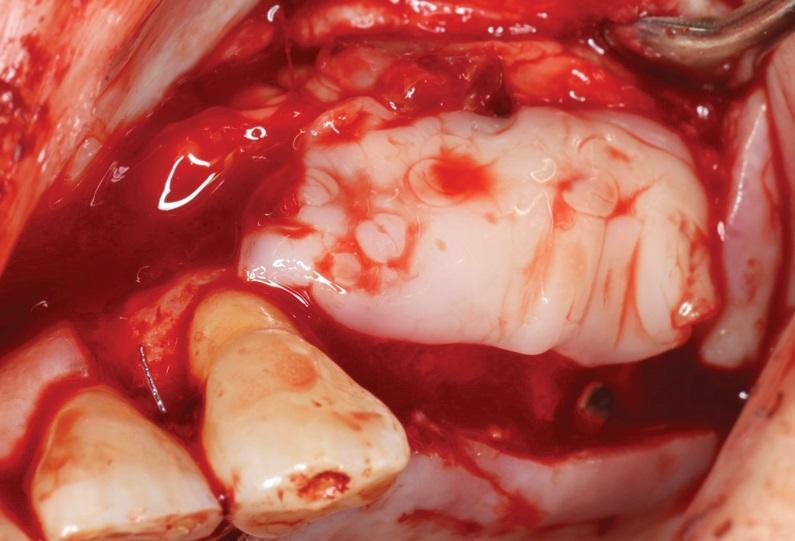
Результаты, полученные при применении PRF-мембран в вышеописанных клинических случаях, были аналогичны таковым при применении коллагеновых мембран. Комбинирование PRF вместе с костными заменителями при восстановлении костного гребня и аугментации постэкстракционных лунок способствовало повышению рентгенологической плотности образовавшейся костной ткани, процентного количества витальной кости, а также более раннему образованию и созреванию костной структуры (фото 7-13). Аналогичные результаты были зарегистрированы и при комбинации костных трансплантатов с PRF в ходе восстановления внутрикостных пародонтальных дефектов. В ходе направленной регенерации тканей именно PRF, а не PRP, способствовало достижению более клинически эффективных исходов лечения.
Фото 7. Дизайн разреза в левом квадранте верхней челюсти для выполнения процедуры синус-лифта.
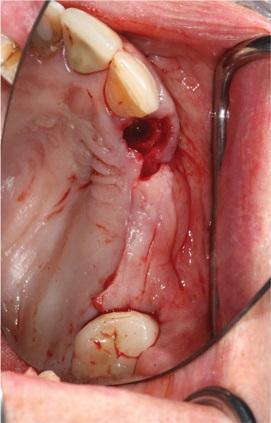
Фото 8. Вид проблемного участка до аугментации.
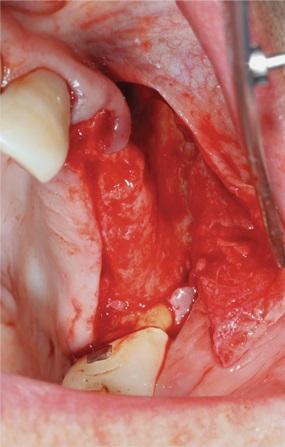
Фото 9. Формирование внутрикостных пенетраций.
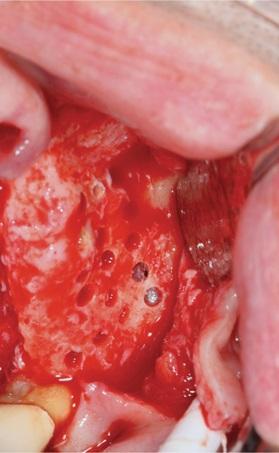
Фото 10. Приготовление PRP для использования в процессе латеральной аугментации костного гребня.
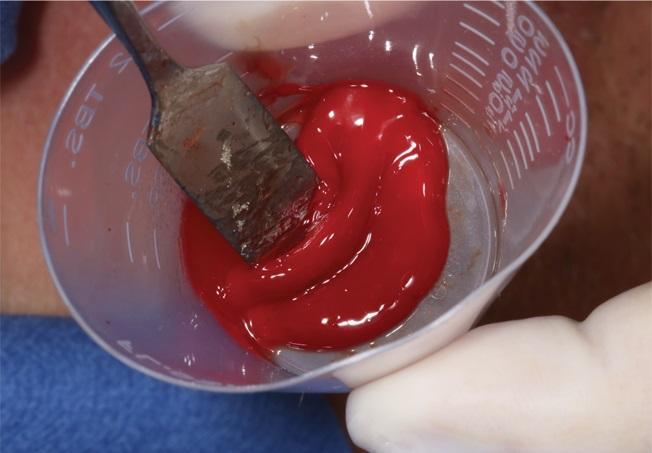
Фото 11. ABBM смешан с PRP перед установкой трансплантата.

Фото 12. Ушивание лоскута после установки мембраны.
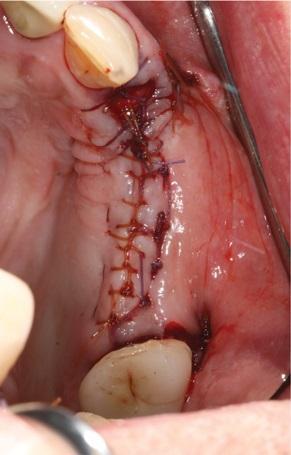
Фото 13. Вид через 2 недели после вмешательства.
Дополнительное использование ТК при регенерации мягких тканей
Дополнительное применение ТК в процессе проведения процедур мягкотканой аугментации способствовало более выраженному восстановлению мягкотканого покрытия корня при комбинации с техникой коронально-перемещенного лоскута; при этом корональное перемещение лоскута в комбинации с соединительнотканевым трансплантатом все же обеспечивало клинически лучшие результаты лечения. Участки десен, восстановленные посредством комбинации ТК и аугментата характеризуются более высокими индексными показателями и большей толщиной сформированных мягких тканей. Также применение ТК позволяет снизить интенсивность послеоперационных болевых ощущений. Также ТК можно использовать в качестве пародонтальных повязок на донорские участки забора соединительнотканевых трансплантатов или свободных десневых трансплантатов (фото 14-15). Это способствует их более быстрому заживлению и эпителизации на протяжении 1 недели с минимальными признаками воспаления. Для сравнения необходимо отметить, что, как правило, неполное заживление донорских участков после забора трансплантатов отмечается лишь на 2 неделе в случаях без применения каких-либо дополнительных гемогенных производных.
Фото 14. L-PRF также может быть использован в форме повязки в донорской области после забора трансплантата.
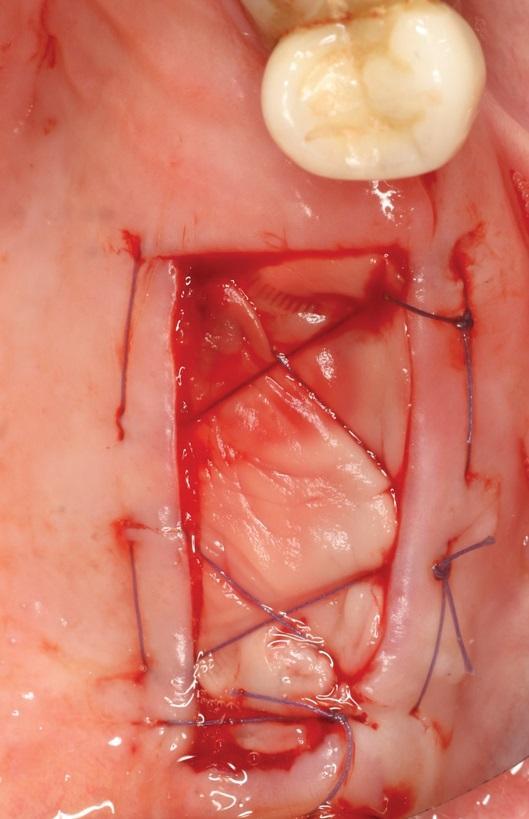
Фото 15. Ушивание L-PRF мембраны в области раны.
Выводы
Тромбоцитарные концентраты являются, по сути, аутологическими трансплантатами, которые врач часто использует в качестве дополнительных агентов во время проведения различных регенераторных манипуляций. Различные типы ТК и усовершенствование протоколов их приготовления позволило открыть новый спектр биологических стоматологических материалов, среди которых врач может выбрать наиболее подходящий для той или иной клинической ситуации. Для оптимизации использования ТК необходима разработка стандартизованных протоколов их приготовления и уницифрованных подходов к исследованию, базируясь на которых можно было бы сделать консенсусный вывод об эффективности гемогенных производных при их применении в ходе мягко- или твердотканой аугментации и регенераторных манипуляций.
Авторы:
Maria L. Geisinger, DDS, MS
Peter Nasseh, DDS
Geisy Galviz, DDS
Karen Y. Jo, DDS
Anthony M. Pikos, DDS, MS
